上海抚生实业有限公司品牌商
9 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
全部产品
- 查看全部分类
- 标准品
- 抗体
- ELISA试剂盒
- PCR相关试剂
- 小鼠elisa检测试剂盒
- 兔elisa检测试剂盒
- 豚鼠elisa检测试剂盒
- 人elisa检测试剂盒
- 羊elisa检测试剂盒
- 犬elisa检测试剂盒
- 猫elisa检测试剂盒
- 绵羊elisa检测试剂盒
- 马elisa检测试剂盒
- 牛elisa检测试剂盒
- 大鼠elisa检测试剂盒
- 鸡elisa检测试剂盒
- 其它elisa检测试剂盒
- ATCC细胞
- 菌种
- 标准品
- 化工产品
- 脂肪酸类
- 化学试剂
- 生化试剂
- 试剂盒
- Elisa检测试剂盒
- 细胞
- 对照品/标准品
- RNA/DNA提取
- 原代细胞
- 培养基
- PCR检测试剂盒
- 美国DRG试剂盒
- 科研抗体
- 生化检测试剂盒
- 科研抗体
- 进口品牌
- 常用标准
- 标准滴定溶液
- XVB标准试液
- 标准指示液
- 生物染色液
- 标准缓冲溶液
- 元素标准溶液
- 纯化水检测试剂
- 锅炉水质分析
- 病理试剂
- 检测试剂
- 生物碱
- 黄酮
- 查尔酮
- 氧杂蒽酮
- 木脂素
- 香豆素
- 苯丙素
- 药物杂质及中间体
- 其它天然产物
- 蒽醌
- 其它醌类
- 甾体
- 二萜
- 其它萜类
- 环烯醚萜
- 倍半萜
- 其它酚类
- 三萜
- 进口检测试剂盒
- PCR试剂盒
- ELISA Kit
- 细胞生物学
- 耗材和仪器
- LAMP试剂盒
- 进口抗体
- FOR ELISA Kit
- PCR基因检测试剂盒
- 鉴定PCR试剂盒
- 进口PCR试剂
- B&I试剂盒
- 小分子试剂
- 细胞系
- 蛋白与多肽
推荐产品
公司新闻/正文
多聚酶链式PCR反应体系与反应条件优化
355 人阅读发布时间:2024-07-02 16:23
PCR全称多聚酶链式反应(polymerase chain reaction),是一种非常强大的技术,可以通过一种非常简单但是高效的方法来复制DNA,它可看作是生物体外的特殊DNA复制,PCR的最大特点是能将微量的DNA大幅增加。
一、主要步骤
典型的PCR由(1)高温变性模板;(2)引物与模板退火;(3)引物沿模板延伸三步反应组成一个循环,通过多次循环反应,使目的DNA得以迅速扩增。
其主要步骤是:将待扩增的模板DNA置高温下(通常为93 ℃-94 ℃,根据具体实验所用酶的要求)使其变性解成单链;人工合成的两个寡核苷酸引物在其合适的复性温度下分别与目的基因两侧的两条单链互补结合,两个引物在模板上结合的位置决定了扩增片段的长短;耐热的DNA聚合酶(Taq 酶)在72 ℃将单核苷酸从引物的3’端开始引入,以目的基因为模板,从5’→3’方向延伸,合成DNA的新互补链。
二、PCR反应条件:
变性、退火 、延伸、循环次数,PCR反应条件提升分析:
1.变性:在第一轮循环前,在94℃下变性5-10min 非常重要,它可使模板DNA wan全解链,然后加入Taq DNA聚合酶(hot start),这样可减少聚合酶在低温下仍有活性从而延伸非特异性配对的引物与模板复合物所造成的错误。变性不wan全,往往使PCR 失败,因为未变性wan全的DNA 双链会很快复性,减少DNA 产量.一般变性温度与时间为94℃ 1min。在变性温度下,双链DNA 解链只需几秒钟即可wan全,所耗时间主要是为使反应体系wan全达到适当的温度。对于富含GC 的序列,可适当提高变性温度,但变性温度过高或时间过长都会导致酶活性的损失。
2. 退火:这是PCR 的一个关键参数。在理想状态下,退火温度足够低,以保证引物同目的序列有效退火,同时还要足够高,以减少非特异性结合。合理的退火温度从55℃到70℃。退火温度一般设定比引物的Tm 低5℃, 当产物中包含有影响实验的非可异性扩增带时,以2℃为增量,逐步提高退火温度。较高的退火温度会减少引物二聚体和非特异性产物的形成。如果两个引物Tm 不同,将退火温度设定为比最di的Tm 低5℃。或者为了提高特异性,可以在根据较高Tm 设计的退火温度先进行5 个循环,然后在根据较低Tm 设计的退火温度进行剩余的循环。这使得在较为严紧的条件下可以获得目的模板的部分拷贝。退火温度越高,所得产物的特异性越高。有些反应甚至可将退火与延伸两步合并,只用两种温度(例如用60℃和94℃)完成整个扩增循环, 既省时间又提高了特异性。退火一般仅需数秒钟即可完成,反应中所需时间主要是为使整个反应体系达到合适的温度。
3. 延伸:延伸反应通常为72℃,接近于Taq DNA 聚合酶的最适反应温度75℃.实际上,引物延伸在退火时即已开始,因为Taq DNA 聚合酶的作用温度范围可从20℃-85℃.延伸反应时间的长短取决于目的序列的长度和浓度.在一般反应体系中,Taq DNA聚合酶每分钟约可合成1kb 长的DNA。延伸时间过长会导致产物非特异性增加.但对很低浓度的目的序列, 则可适当增加延伸反应的时间。一般在扩增反应完成后,都需要一步较长时间(10-30min)的延伸反应,以获得尽可能完整的产物, 这对以后进行克隆或测序反应尤为重要。
4. 循环次数: 当其它参数确定之后, 循环次数主要取决于DNA 浓度。一般而言25-30轮循环已经足够。循环次数过多,会使PCR 产物中非特异性产物大量增加。通常经25-30 轮循环扩增后, 反应中Taq DNA 聚合酶已经不足, 如果此时产物量仍不够, 需要进一步扩增,可将扩增的DNA 样品稀释103-105倍作为模板, 重新加入各种反应底物进行扩增, 这样经60 轮循环后, 扩增水平可达109-1010。扩增产物的量还与扩增效率有关,扩增产物的量可用下列公式表示:C=Co(1+P)n 。其中:C 为扩增产物量,C0 为起始DNA 量, P 为增效率, n 为循环次数。在扩增后期,由于产物积累,使原来呈指数扩增的反应变成平坦的曲线,产物不再随循环数而明显上升,这称为平台效应。平台期会使原先由于错配而产生的低浓度非特异性产物继续大量扩增,达到较高水平。因此,应适当调节循环次数,在平台期前结束反应,减少非特异性产物。
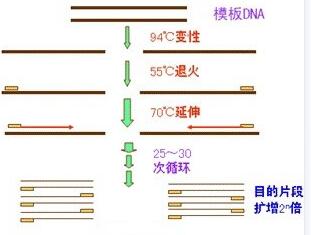
三、PCR反应体系的组成与反应条件的优化
PCR反应体系由反应缓冲液(PCR Buffer)、脱氧核苷三磷酸底物(dNTP mix)、耐热DNA聚合酶(Taq 酶)、寡聚核苷酸引物(Primer1,Primer2)、靶序列(DNA模板)五部分组成。各个组份对PCR结果至关重要。
1. 反应缓冲液:一般随Taq DNA聚合酶试剂盒供应。
标准缓冲液含:50mM KCl,10mM Tris-HCl(pH8.3,室温),1.5mM MgCl2。Mg2+的浓度对反应的特异性及产量有着显著影响;浓度过高,使反应特异性降低;浓度过低,使产物减少。在各种单核苷酸浓度为200 μM时,Mg2+为1.5 mM较合适。若样品中含EDTA或其它螯合物,可适当增加Mg2+的浓度,在高浓度DNA及dNTP条件下进行反应时,也必须相应调节Mg2+的浓度。据经验,一般以1.5-2mM(终浓度)较好(仅供参考)。
2. dNTP :高浓度dNTP易产生错误掺入,过高则可能不扩增;但浓度过低,将降低反应产物的产量。PCR中常用终浓度为50-400 μM的dNTP。四种脱氧三磷酸核苷酸的浓度应相同,如果其中任何一种的浓度明显不同于 其它几种时(偏高或偏低),就会诱发聚合酶的错误掺入作用,降低合成速度,过早终止延伸反应。此外,dNTP能与Mg2+结合,使游离的Mg2+浓度降低。因此,dNTP的浓度直接影响到反应中起重要作用的Mg2+浓度。
3. Taq DNA聚合酶:在100μL反应体系中,一般加入2-4U的酶量,足以达到每min延伸1000-4000个核苷酸的掺入速度。酶量过多将导致产生非特异性产物。但是,不同的公司或不同批次的产品常有很大的差异,由于酶的浓度对 PCR 反应影响极大,因此应当作预试验或使用厂家推荐的浓度。当降低反应体积时(如20μL或 50 μL),一般酶的用量仍不小于2U,否则反应效率将降低。
4. 引物:引物是扩增PCR结果的关键,引物设计在PCR反应中极为重要。要保证PCR反应能准确、特异、有效地对模板DNA进行扩增,通常引物设计要遵循以下几条原则:
(1)引物的长度以15-30 bp为宜,通常设计长度为17-25bp;GC含量在40-60%(最好在45-55%);两条引物的Tm值应尽量接近,可以采用专用软件来计算(Primer Premier 5);尽量避免A/G或T/C的连续排列,局部避免GC rich或AT rich(特别是3’端),碱基的分布应表现出是随机的。
(2)互补性,引物内部或两条引物之间避免3个碱基以上的互补序列,引物末端避免2base以上的互补序列。引物的3’端不应与引物内部有互补,避免引物内部形成二级结构,两个引物在3’端不应出现同源性,以免形成引物二聚体。3’端末位碱基(最好是G或C,避免为T)在很大程度上影响着Taq酶的延伸效率。
(3)引物浓度不宜偏高,浓度过高有两个弊端:一是容易形成引物二聚体(primer-dimer),二是当扩增微量靶序列并且起始材料又比较粗时,容易产生非特异性产物。一般说来,用低浓度引物不仅经济,而且反应特异性也较好。一般用0.25-0.5pM/μL较好。
(4)引物一般用TE配制成较高浓度的母液(约100 μM),保存于-20 ℃。使用前取出其中一部分用ddH2O配制成10 μM或20 μM的工作液。
5.模板:PCR对模板的要求不高,单、双链DNA均可作为PCR模板。虽然 PCR 可以微量的样品(甚至是来自单一细胞的DNA)作为模板,但为了保证反应的特异性,一般还宜用μg水平的基因组DNA或 拷贝数较高的待扩增片段作为起始模板。原材料可以是粗制品,某些材料甚至仅需用溶剂一步提取之后即可用于扩增,但混有任何蛋白酶、核酸酶、Taq DNA 聚合酶抑制剂以及能结合 DNA 的蛋白,将可能干扰PCR反应。
6. PCR循环加快,即相对减少变性、复性、延伸的时间,可增加产物的特异性。
四、注意事项
1.PCR应该在没有DNA污染的干净环境中进行,最好设立一个专用的PCR配制室、模板室、扩增室,避免污染(16S)。
2.纯化模板所选用的方法对污染的风险有极大影响。一般而言,只要能够得到可靠的结果,纯化的方法越简单越好。
3.所有试剂都应该没有核酸和核酸酶的污染,操作过程中均应戴手套。
4.PCR试剂配制应使用最高质量的新鲜双蒸水,采用0.22μm滤膜过滤除菌或高温高压灭菌。5.试剂都应该以大体积配制,然后分装成仅够一次使用的量储存,从而确保实验与实验之间的连续性与平行性。
6.试剂或样品准备过程中都要使用灭菌的tubes和tips,玻璃器皿应洗涤干净并高压灭菌。
7.PCR配制试剂应在冰上融化,并且要瞬离并充分混匀。
一、主要步骤
典型的PCR由(1)高温变性模板;(2)引物与模板退火;(3)引物沿模板延伸三步反应组成一个循环,通过多次循环反应,使目的DNA得以迅速扩增。
其主要步骤是:将待扩增的模板DNA置高温下(通常为93 ℃-94 ℃,根据具体实验所用酶的要求)使其变性解成单链;人工合成的两个寡核苷酸引物在其合适的复性温度下分别与目的基因两侧的两条单链互补结合,两个引物在模板上结合的位置决定了扩增片段的长短;耐热的DNA聚合酶(Taq 酶)在72 ℃将单核苷酸从引物的3’端开始引入,以目的基因为模板,从5’→3’方向延伸,合成DNA的新互补链。
二、PCR反应条件:
变性、退火 、延伸、循环次数,PCR反应条件提升分析:
1.变性:在第一轮循环前,在94℃下变性5-10min 非常重要,它可使模板DNA wan全解链,然后加入Taq DNA聚合酶(hot start),这样可减少聚合酶在低温下仍有活性从而延伸非特异性配对的引物与模板复合物所造成的错误。变性不wan全,往往使PCR 失败,因为未变性wan全的DNA 双链会很快复性,减少DNA 产量.一般变性温度与时间为94℃ 1min。在变性温度下,双链DNA 解链只需几秒钟即可wan全,所耗时间主要是为使反应体系wan全达到适当的温度。对于富含GC 的序列,可适当提高变性温度,但变性温度过高或时间过长都会导致酶活性的损失。
2. 退火:这是PCR 的一个关键参数。在理想状态下,退火温度足够低,以保证引物同目的序列有效退火,同时还要足够高,以减少非特异性结合。合理的退火温度从55℃到70℃。退火温度一般设定比引物的Tm 低5℃, 当产物中包含有影响实验的非可异性扩增带时,以2℃为增量,逐步提高退火温度。较高的退火温度会减少引物二聚体和非特异性产物的形成。如果两个引物Tm 不同,将退火温度设定为比最di的Tm 低5℃。或者为了提高特异性,可以在根据较高Tm 设计的退火温度先进行5 个循环,然后在根据较低Tm 设计的退火温度进行剩余的循环。这使得在较为严紧的条件下可以获得目的模板的部分拷贝。退火温度越高,所得产物的特异性越高。有些反应甚至可将退火与延伸两步合并,只用两种温度(例如用60℃和94℃)完成整个扩增循环, 既省时间又提高了特异性。退火一般仅需数秒钟即可完成,反应中所需时间主要是为使整个反应体系达到合适的温度。
3. 延伸:延伸反应通常为72℃,接近于Taq DNA 聚合酶的最适反应温度75℃.实际上,引物延伸在退火时即已开始,因为Taq DNA 聚合酶的作用温度范围可从20℃-85℃.延伸反应时间的长短取决于目的序列的长度和浓度.在一般反应体系中,Taq DNA聚合酶每分钟约可合成1kb 长的DNA。延伸时间过长会导致产物非特异性增加.但对很低浓度的目的序列, 则可适当增加延伸反应的时间。一般在扩增反应完成后,都需要一步较长时间(10-30min)的延伸反应,以获得尽可能完整的产物, 这对以后进行克隆或测序反应尤为重要。
4. 循环次数: 当其它参数确定之后, 循环次数主要取决于DNA 浓度。一般而言25-30轮循环已经足够。循环次数过多,会使PCR 产物中非特异性产物大量增加。通常经25-30 轮循环扩增后, 反应中Taq DNA 聚合酶已经不足, 如果此时产物量仍不够, 需要进一步扩增,可将扩增的DNA 样品稀释103-105倍作为模板, 重新加入各种反应底物进行扩增, 这样经60 轮循环后, 扩增水平可达109-1010。扩增产物的量还与扩增效率有关,扩增产物的量可用下列公式表示:C=Co(1+P)n 。其中:C 为扩增产物量,C0 为起始DNA 量, P 为增效率, n 为循环次数。在扩增后期,由于产物积累,使原来呈指数扩增的反应变成平坦的曲线,产物不再随循环数而明显上升,这称为平台效应。平台期会使原先由于错配而产生的低浓度非特异性产物继续大量扩增,达到较高水平。因此,应适当调节循环次数,在平台期前结束反应,减少非特异性产物。

三、PCR反应体系的组成与反应条件的优化
PCR反应体系由反应缓冲液(PCR Buffer)、脱氧核苷三磷酸底物(dNTP mix)、耐热DNA聚合酶(Taq 酶)、寡聚核苷酸引物(Primer1,Primer2)、靶序列(DNA模板)五部分组成。各个组份对PCR结果至关重要。
1. 反应缓冲液:一般随Taq DNA聚合酶试剂盒供应。
标准缓冲液含:50mM KCl,10mM Tris-HCl(pH8.3,室温),1.5mM MgCl2。Mg2+的浓度对反应的特异性及产量有着显著影响;浓度过高,使反应特异性降低;浓度过低,使产物减少。在各种单核苷酸浓度为200 μM时,Mg2+为1.5 mM较合适。若样品中含EDTA或其它螯合物,可适当增加Mg2+的浓度,在高浓度DNA及dNTP条件下进行反应时,也必须相应调节Mg2+的浓度。据经验,一般以1.5-2mM(终浓度)较好(仅供参考)。
2. dNTP :高浓度dNTP易产生错误掺入,过高则可能不扩增;但浓度过低,将降低反应产物的产量。PCR中常用终浓度为50-400 μM的dNTP。四种脱氧三磷酸核苷酸的浓度应相同,如果其中任何一种的浓度明显不同于 其它几种时(偏高或偏低),就会诱发聚合酶的错误掺入作用,降低合成速度,过早终止延伸反应。此外,dNTP能与Mg2+结合,使游离的Mg2+浓度降低。因此,dNTP的浓度直接影响到反应中起重要作用的Mg2+浓度。
3. Taq DNA聚合酶:在100μL反应体系中,一般加入2-4U的酶量,足以达到每min延伸1000-4000个核苷酸的掺入速度。酶量过多将导致产生非特异性产物。但是,不同的公司或不同批次的产品常有很大的差异,由于酶的浓度对 PCR 反应影响极大,因此应当作预试验或使用厂家推荐的浓度。当降低反应体积时(如20μL或 50 μL),一般酶的用量仍不小于2U,否则反应效率将降低。
4. 引物:引物是扩增PCR结果的关键,引物设计在PCR反应中极为重要。要保证PCR反应能准确、特异、有效地对模板DNA进行扩增,通常引物设计要遵循以下几条原则:
(1)引物的长度以15-30 bp为宜,通常设计长度为17-25bp;GC含量在40-60%(最好在45-55%);两条引物的Tm值应尽量接近,可以采用专用软件来计算(Primer Premier 5);尽量避免A/G或T/C的连续排列,局部避免GC rich或AT rich(特别是3’端),碱基的分布应表现出是随机的。
(2)互补性,引物内部或两条引物之间避免3个碱基以上的互补序列,引物末端避免2base以上的互补序列。引物的3’端不应与引物内部有互补,避免引物内部形成二级结构,两个引物在3’端不应出现同源性,以免形成引物二聚体。3’端末位碱基(最好是G或C,避免为T)在很大程度上影响着Taq酶的延伸效率。
(3)引物浓度不宜偏高,浓度过高有两个弊端:一是容易形成引物二聚体(primer-dimer),二是当扩增微量靶序列并且起始材料又比较粗时,容易产生非特异性产物。一般说来,用低浓度引物不仅经济,而且反应特异性也较好。一般用0.25-0.5pM/μL较好。
(4)引物一般用TE配制成较高浓度的母液(约100 μM),保存于-20 ℃。使用前取出其中一部分用ddH2O配制成10 μM或20 μM的工作液。
5.模板:PCR对模板的要求不高,单、双链DNA均可作为PCR模板。虽然 PCR 可以微量的样品(甚至是来自单一细胞的DNA)作为模板,但为了保证反应的特异性,一般还宜用μg水平的基因组DNA或 拷贝数较高的待扩增片段作为起始模板。原材料可以是粗制品,某些材料甚至仅需用溶剂一步提取之后即可用于扩增,但混有任何蛋白酶、核酸酶、Taq DNA 聚合酶抑制剂以及能结合 DNA 的蛋白,将可能干扰PCR反应。
6. PCR循环加快,即相对减少变性、复性、延伸的时间,可增加产物的特异性。
四、注意事项
1.PCR应该在没有DNA污染的干净环境中进行,最好设立一个专用的PCR配制室、模板室、扩增室,避免污染(16S)。
2.纯化模板所选用的方法对污染的风险有极大影响。一般而言,只要能够得到可靠的结果,纯化的方法越简单越好。
3.所有试剂都应该没有核酸和核酸酶的污染,操作过程中均应戴手套。
4.PCR试剂配制应使用最高质量的新鲜双蒸水,采用0.22μm滤膜过滤除菌或高温高压灭菌。5.试剂都应该以大体积配制,然后分装成仅够一次使用的量储存,从而确保实验与实验之间的连续性与平行性。
6.试剂或样品准备过程中都要使用灭菌的tubes和tips,玻璃器皿应洗涤干净并高压灭菌。
7.PCR配制试剂应在冰上融化,并且要瞬离并充分混匀。